早在针对 SARS-CoV-2 的 mRNA 疫苗将这项技术推向舞台中央之前,mRNA 就已被确定为是一种潜在的抗肿瘤疫苗接种方法,而现在,鉴于COVID-19疫苗的巨大成功,mRNA已被探索用于其它各种领域,包括针对其它传染病的疫苗、抗肿瘤疫苗以及蛋白质补充/替代疗法等。尽管mRNA对几乎无处不在的核糖核酸酶敏感并且可能会快速降解,但其同样具有强大的安全性优势,非复制意味着它不与基因组相互作用,而其相对不稳定性和体内快速代谢清除可以通过使用各种修饰来调节。现有的成功经验已经证实,将mRNA制剂到不同的载体结构中后,可实现给药后的快速摄取和高效蛋白质表达。
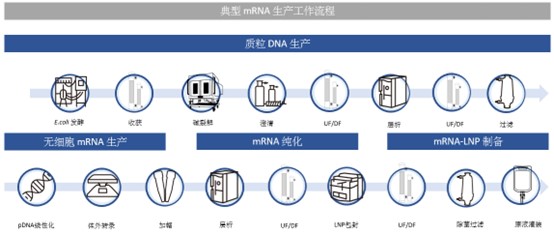
完整的 mRNA 生产过程面临多方面的挑战,包括与起始物料(质粒DNA,pDNA)相关的挑战,以及mRNA自身的特殊属性相关所带来的挑战,如其对几乎无处不在的核糖核酸酶的高度敏感性、对工艺过程产生中的剪切的高度敏感性,以及由于mRNA与某些杂质(如双链 RNA 或 dsRNA)的大小相似而导致的分离纯化挑战。在获得所需目的序列的pDNA模板之后,mRNA的无细胞下游生产步骤可以概括为:
在称为体外转录 (IVT) 的酶促反应过程中合成mRNA,即将目标 DNA 序列的模板 – 线性化pDNA、核苷酸 (NTP) 以及酶混合在一起。
然后使用层析、切向流过滤和除菌过滤等步骤,从反应混合物/污染物中得到纯化转录 mRNA。
最后将 mRNA 封装在一般由4种脂质成分组成的脂质纳米颗粒(LNP)中,最终产品在无菌灌装之前使用切向流过滤 (TFF) 和/或层析进行纯化及浓缩。
生产 mRNA 的挑战
mRNA的合成
mRNA 的无细胞合成需要 pDNA 模板被限制酶线性化,该酶将在超螺旋质粒的特定部分进行切割。需要去除与此步骤相关的杂质,如使用切向流过滤和/或层析。然后,将线性化的 DNA 模板在体外转录(IVT)成 mRNA。将 RNA 聚合酶(如T7 RNA聚合酶)和三磷酸核苷酸添加到线性化且纯化的 pDNA 中。为了增加 mRNA 的稳定性和/或降低免疫原性,可以使用一些修饰的三磷酸核苷酸。当然,这种策略的商业化应用需要考虑到专利保护的问题。为了稳定并允许在细胞中进行有效的 mRNA 转导,需要 3' poly-(A) 尾和 5' 帽。 Poly-(A) 尾对于终止蛋白质转录和翻译至关重要,它可以防止 3' 核酸外切酶消化 mRNA。 5' 帽通过防止 5' 核酸外切酶降解来稳定 mRNA。可以使用两种方法来给 mRNA 加帽。加帽可以发生在转录步骤中,或者,可以在 IVT 后,使用牛痘病毒加帽酶,以酶促方式实现加帽,后者通常加帽效率更高,但需要先纯化 mRNA。
mRNA的纯化
在 IVT 之后,转录的 3’poly-(A)-mRNA-5'帽产物需要从可能存在内毒素、免疫原性 dsRNA、残留 DNA 模板、RNA 聚合酶、截短的 RNA 片段、未使用的三磷酸核苷酸和加帽反应过程中产生的其它杂质的混合物中纯化。有多种选项可用于 mRNA 的纯化,通常包括一或两步的层析步骤,以及基于切向流过滤的超滤/洗滤步骤。
亲和层析是常用的高效纯化策略,如Poly (dT) 层析,其通过捕获带 poly-A 尾的 mRNA,有效去除 DNA、核苷酸、酶、缓冲液成分等不带 poly-(A) 尾的杂质,但不能将 dsRNA 与单链RNA (ssRNA) 区分开来。初始亲和层析之后,通常是第二个层析步骤,称为精纯步骤,以进一步纯化 ssRNA,例如使用阴离子交换层析。有时,也会结合使用离子交换和疏水作用层析。
使用截留分子量范围为 30 至 300 kDa 的切向流过滤是将 mRNA 与较小的杂质进行分离的替代性方式,使用切向流过滤也可在同一单元操作中进行浓缩和洗滤换液。
在标准批次模式 IVT 工艺中,在反应完成后从反应混合物中纯化所需的 RNA 产物,而聚合酶、pDNA 模板和未反应的三磷酸核苷被丢弃。但由于这些 IVT 反应组分价格昂贵,已经有开发人员尝试使用类似补料分批的转录策略来进行大规模 mRNA 生产,过程中,监测 IVT 反应的进程,以保持最佳反应条件,并在反应过程中,将组分按需添加到反应器中。获得完整的全长 RNA 产物的效率,或出现截短的转录物的几率,取决于 RNA 序列和反应条件的精确控制,需要优化,以提高工艺产量。
封装 mRNA
RNA 对到处存在的核糖核酸酶的快速降解高度敏感,这就需要一个有效的系统,不仅可以稳定 mRNA,还可以将 mRNA 引入细胞。 mRNA 与递送系统的混合、以及各种脂质聚合物成分的选择组合,已被证明可以保护 mRNA 免受核糖核酸酶降解,增强细胞摄取,并改善在靶细胞中的 mRNA 翻译。
脂质纳米颗粒 (LNP) 是最常用的 mRNA 递送系统;其通常由4种不同的脂质成分组成,包括可电离阳离子脂质、辅助融合磷脂、胆固醇以及聚乙二醇(PEG)-脂质。将mRNA 封装在脂质复合物中,可使其免受核糖核酸酶降解,同时将其有效地递送到细胞的细胞质中。
LNP 制备的第一个步骤是将脂质溶解在溶剂(例如乙醇)中,然后使用错流或微流体混合器将溶解的脂质与含有mRNA 的低 pH 值水性缓冲液快速混合,以获得包封mRNA的LNP,对混合流道、速度等的优化控制是获得所需粒径大小、粒径分布以及包封效率等特性的关键。对产生的 mRNA-LNP 复合物进行洗滤,以用中性缓冲液代替低 pH 缓冲液。此步骤应快速进行,以避免在低 pH 值下观察到的脂质降解。然后通过超滤方法进行浓缩。
LNP 的缺点包括它们可能需要冷链物流。此外,鉴于LNP的粒径,并不总是可以对其进行除菌过滤,在这种情况下,必须考虑替代方案,例如采用完全一次性的封闭式工艺。
暂无
Copyright © 上海多宁生物科技股份有限公司 版权所有 网站地图 | 技术支持: 备案号:沪ICP备20017026号-2
备案号:沪ICP备20017026号-2
留言框-